العوامل المؤثرة في الذوبان
الفكرة الرئيسية: يتأثر تكون المحلول بعوامل , منها الحرارة و الضغط و القطبية .
عملية الذوبان : هي إحاطة جسيمات المذاب بجسيمات المذيب .
ــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــ
” المذيب يذيب شبيهه ” قاعدة عامة تستعمل لتحديد ما إذا كانت عملية الذوبان تحدث في مذيب معين ، و لتحديد ما إذا كان المذيب والمذاب متماثلين يجب دراسة قطبية المركبات و نوع الروابط بين الجزئية فيها.
مثل : يأخذ الملح في الأنفصال عندما يوضع في الماء إذ تسحب جسيمات المذاب و تحاط بجسيمات المذيب.
ــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــ
- محاليل المركبات الأيونية : يذوب كلوريد الصوديوم في الماء عندما تحيط جزيئات الماء بأيونات الصوديوم و الكلوريد , تحيط جزيئات الماء القطبية بكل من أيونات الكلور السالبة و أيونات الصوديوم الموجبة .
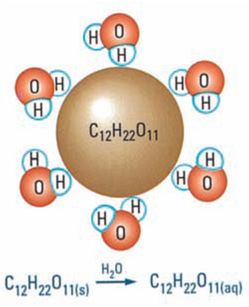
- محاليل المركبات الجزيئية : يحتوي جزئ السكروز على 8 روابط O – H قطبية , و تكون جزيئات الماء القطبية روابط هيدروجينية مع الروابط O – H في السكروز, وتسحب جزيئات السكروز نحو المحلول.
- حرارة الذوبان : هو التغير الكلي للطاقة الذي يحدث خلال عملية تكون المحلول .
ــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــ
لأن قوى التجاذب بين أيونات الجبس قوية بحيث لا تستطيع قوى التجاذب بين جزيئات الماء التغلب عليها

- علل لا يذوب الزيت في الماء ؟
لأن جزيئات الماء قطبية وجزيئات الزيت غير قطبية
ــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــ
العوامل المؤثرة في الذوبان : ثلاث طرائق شائعة لزيادة التصادمات بين جسيمات المذاب و المذيب و زيادة سرعة الذوبان , وهي :
- التحريك:
يعمل تحريك المحلول على إبعاد جسيمات المذاب عن سطوح التماس بسرعة أكبر .
- مساحة السطح :
إن تكسير المذاب إلى قطع صغيرة يزيد من مساحة سطحه. وتساعد الزيادات في مساحة السطح على زيادة عدد التصادمات التي تحدث بين جسيماتة و جسيمات المذيب .
- الحرارة :
المذيب الساخن يذيب كمية اكبر من المذاب مقارنة بالمذيب البارد لذلك يستوعب الشاي الساخن سكرا ذائبا أكثر من الشاي المثلج. إلا ان ذوبان بعض المواد الأخرى و منها الغازات يقل بزيادة درجة الحرارة و هذا يجعل المشروبات الغازية تفقد طعمها اللاذع أسرع عند درجة حرارة الغرفة مما لو كانت باردة.
ــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــ
الذائبية : تعرف على أنها أقصى كمية من المذاب يمكن أن تذوب في كمية محددة من المذيب عند درجة حرارة معينة.
ذائبية الغازات : تقل ذائبية غازي الأكسجين و ثاني أكسيد الكربون عند درجات الحرارة المرتفعة مقارنة بدرجات الحرارة المنخفضة , وهذا سلوك متوقع لجميع المواد الغازية المذابة في المذيبات السائلة , تذكر أن الطاقة الحركية لجسيمات الغاز تسمح للجسيمات بالتحرر أو النفاد من المحلول بسهولة اكبر عند درجات حرارة مرتفعة , و لذلك كل ما زادت درجة حرارة المحلول قلت ذائبية المذاب الغازي .
ــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــ
- المحلول الغير مشبع : يحتوي على كمية مذاب أقل مما في المحلول المشبع عند درجة حرارة و ضغط معينين أي أنه يمكن إضافة كميات أكبر من المذاب إلى المحلول غير المشبع.
- المحلول المشبع : يحتوي على أكبر كمية من المذاب ذائبة في كمية محددة من المذيب عند درجة حرارة و ضغط معينين.
- المحاليل فوق المشبعة : يحتوي على كمية أكبر من المادة المذابة مقارنة بحلول مشبع عند درجة الحرارة نفسها.
ــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــ
الضغط و قانون هنري : يؤثر الضغط في ذائبية المواد الغازية المذابة في المحاليل فكلما ازداد الضغط فوق المحلول زادت ذائبية الغاز في أي مذيب . تعتمد المشروبات الغازية على هذا المبدأ .
- ينص قانون هنري على أن ” تتناسب ذائبية الغاز في سائل (S) تناسبا طرديا مع ضغط الغاز (P) الموجود فوق سائل عند ثبوت درجة الحرارة “
- قانون هنري : S1/P1 = S2/P2
- مثال : إذا ذاب 0.55g من غاز ما في 1L من الماء عند ضغط 20kPa . فما كمية الغاز نفسه التي تذوب عند ضغط 110kPa ؟
3.025g = (0.55×110)/20 = S2