تركز المحلول
الفكرة الرئيسة: يمكن التعبير عن التركيز بدلالة النسبة المؤية أو المولات.
التركيز: المحلول مقياسياً يعبر عن كمية المذاب الذائبة في كمية محددة من المذيب أو المحلول.
* هناك عدة طرائق للتعبير عن التركيز وهي :
١- النسبة المئوية بدلالة الكتلة : (كتلة المحلول / كتلة المذاب )×100
مثال: ما النسبة المؤية بدلالة الكتلة لمحلول يحتوي على 20g من كربونات الصوديوم الهيدروجينية مذابة في 100g من الماء ؟
النسبة المئوية بدلالة الكتلة = (20/100)×%100 = %20
ــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــ
٢- النسبة المئوية بدلالة الحجم : (حجم المحلول / حجم المذاب )×100
مثال:ما النسبة المؤية بدلالة الحجم لللإيثانول في محلول يحتوي على 35ml مذاب في 155ml ماء ؟
النسبة المئوية بدلالة الحجم = (35/155)×%100 = %22.5
ــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــ
٣- المولارية (التركيز المولاري) (M) :
* وحدة المولارية هي: (M)
المولارية = ( حجم المحلول L / عدد مولات المذاب mol )
مثال: ما التركيز المولاري لمحلول حجمه 1L يحتوي على mol 0.5 من المذاب
المولارية = (0.5/1) = 0.5 M
* معادلة التخفيف: M M1.V1 = M2.V2 = المولارية V = الحجم
مثال: ما حجم المحلول القياسي (الابتدائي) بالمللتر 3M KI اللازم لتحضيرمخفف منه تركيزه 1.25M و حجمه 0.3L ؟
V1 = (0.3×1.25) / 3
V1 = 0.125 L
V1 = 125 ml
ــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــ
٤- المولالية (التركيز المولالي) (m) :
المولالية = (كتلة المذيب kg / عدد مولات المذاب mol )
* تركيز المحلول الذي يحتوي على 1mol من المذاب في 1kg من المذيب هو 1 محلول مولالي (m)
مثال: ما مولالية محلول يحتوي على 0.77mol من كبريتات الصوديوم ذائبة في 1000g ماء ؟
المولالية = ( 1000÷1000 / 0.77 ) = 0.77m
ــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــــ
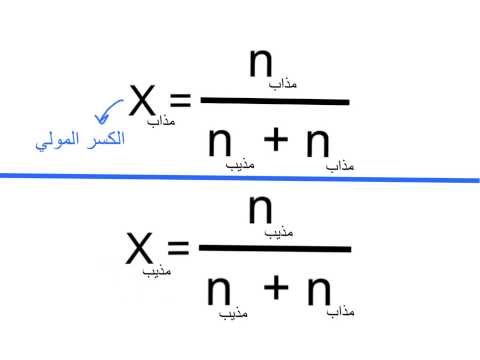
٥- الكسر المولي:
الكسر المولي : هو نسبة عدد مولات المذاب أوالمذيب في المحلول إلى عدد المولات الكلية للمذيب والمذاب .
مثال : محلول يحتوي على 5mol من المذاب و 15mol من المذيب فما الكسر المولي للمذيب ؟
Xالمذيب = (5+5/15)
Xالمذيب = 0.25